Global Manuka Honey Market Snapshot:
A new report titled “Global Manuka Honey Market” has been added to its vast repository by Straits Research. The report analyzes and estimates the market on a global, regional, and country level. The report offers data from previous years along with an in-depth analysis from 2025 to 2033 on the basis of revenue (USD Billion or Million). Besides, the report offers a comprehensive analysis of the factors driving and restraining the growth of the market, coupled with the impact they have on the demand over the forecast period. In addition, the report includes the study of lucrative opportunities available in the Manuka Honey market on a global level.
Request Sample Report of Global Market @ https://straitsresearch.com/report/manuka-honey-market/request-sample
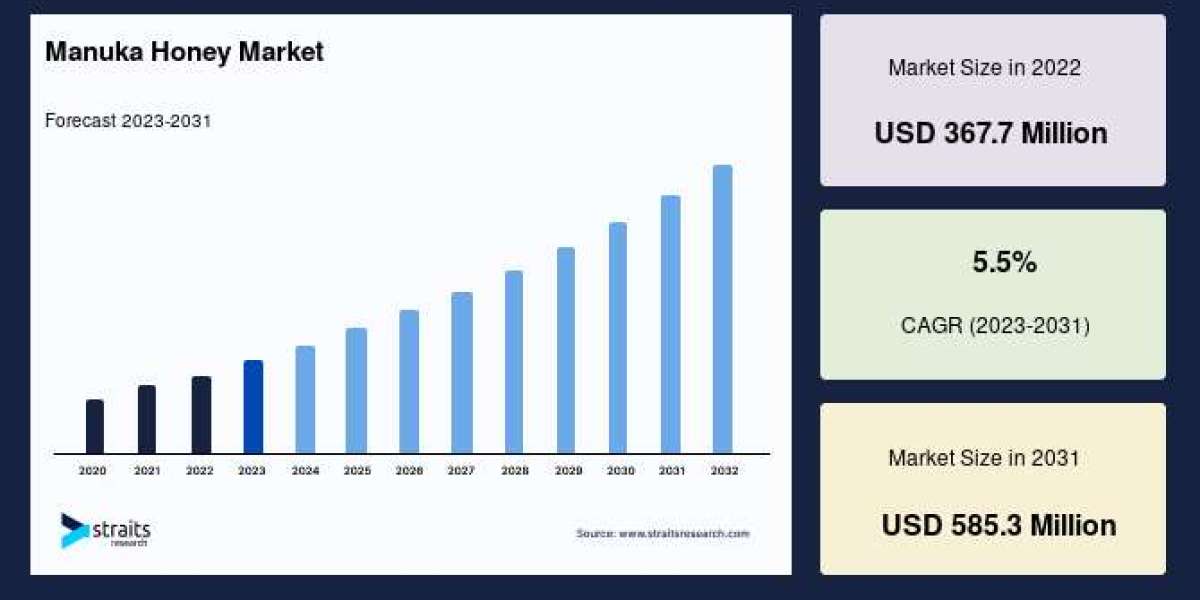
According to StraitsResearch, the global manuka honey market size is valued at USD 367.7 million in 2022 and is estimated to reach USD 585.3 million by 2031, growing at a CAGR of 5.5% during 2023-2031.
This report forecasts revenue growth at the global, regional, and local levels and provides an analysis of the most recent industry trends from 2025 to 2033 in each of the segments and sub-segments. Some of the major geographies included in the market are given below:
- North America(U.S., Canada)
- Europe(U.K., Germany, France, Italy)
- Asia Pacific(China, India, Japan, Singapore, Malaysia)
- Latin America(Brazil, Mexico)
- Middle East & Africa
Top Key Industry Players:
- Comvita Limited
- Steens Honey
- Manuka Health New Zealand
- Berringa
- Australias Manuka
- GO Healthy New Zealand Ltd.
- Simply Honey
- Barnes Natural
- Natures Gold
- New Zealand Honey Co.
- Haddrells
- Mossops Honey.
The report helps businesses get a thorough understanding of the industry landscape by providing a comprehensive examination of the key business opportunities, global trends, and supply-demand scope. In addition, the study gives an in-depth overview of the market revenue, status demand, competitive landscape, and regional assessment on a global scale. It is an important value addition for any company looking to develop effective business strategies and begin transformative growth.
The market is segmented into different sections such as: by product type, by application, by end-users, by deployment mode, and by key geography. The report then employs market breakdown and data triangulation procedures to complete the overall market engineering process and arrive at the exact statistics for all segments and sub-segments. The report on the Global Manuka Honey Market has been curated by analyzing the top players functioning in the market. In order to get an in-depth analysis of the market, the report carried out a SWOT analysis, Porter’s five forces analysis, and PESTEL analysis.
Manuka Honey Market Segmentation:
- By Product Type
- MGO 83
- MGO 263
- MGO 514
- MGO 829
- Others
- By Category
- Conventional
- Organic
- By Distribution Channel
- Store-Based
- Non-Store-Based
- By Region
- North America
- Asia-Pacific
- Europe
- The Middle East and Africa
- Latin America
Global Regional Outlook:
Europe: Europe is currently the largest market for Manuka Honey, accounting for a significant share of the global market.
Asia Pacific: While the Europe leads in market size, Asia Pacific is emerging as the fastest growing region in the Manuka Honey market.
Key Questions Answered in the Report:
- What is the current scenario of the Global Manuka Honey industry? How is the market going to prosper throughout the next 5 years?
- What is the historical and current size of the Global Manuka Honey Market?
- Which segments are the fastest growing and the largest in the market? What is their market potential?
- What are the driving factors contributing to the market growth during the short, medium, and long term?
- What are the lucrative opportunities for the key players in the market?
- Which are the key geographies from the investment perspective?
- What are the major strategies adopted by the leading players to expand their market shares?
- What are sales, revenue, and price analysis by types and applications of the market?
About Us:
Straits Research is a leading market research and market intelligence organization, specializing in research, analytics, and advisory services along with providing business insights & market research reports.
Contact Us:
Email: sales@straitsresearch.com
Tel: +1 646 905 0080 (U.S.), +44 203 695 0070 (U.K.)